当研究室は、動物細胞、特に神経系を材料に、細胞の増殖・分化・生死という生命の根幹を支える細胞運命決定のメカニズムを、分子レベルで理解することを目指している。
1. はじめに
2. 細胞の生死制御とがん化
3. 大脳発生における神経系前駆細胞(神経幹細胞)の運命制御
1.はじめに
生物の発生過程において、細胞は増殖と生死を厳密に制御されながら、様々な形質を持った細胞へと分化していく。また発生後の成体においても、個々の細胞の増殖・分化・細胞死は、個体としての恒常性を保つために厳密に制御されている。この個々の細胞運命は、基本的に細胞外シグナルが細胞膜上の受容体を介してコントロールしていることが多いが、我々は、受容体に始まる「細胞内シグナル伝達」がいかに情報を核に伝え、遺伝情報の制御に結びつけているのか、に注目している。我々のグループは、「細胞内シグナル伝達」において中心的な役割を果たしている
MAPキナーゼのカスケード の同定に貢献し、その制御機構を明らかにしてきた。MAPキナーゼカスケードは、原癌遺伝子Rasの下流で活性化し細胞増殖シグナルとして働くだけでなく、様々な分化のシグナル伝達においても重要な役割を果たしている。MAPキナーゼカスケードが脊椎動物だけでなく、酵母・植物・無脊椎動物など広範な生物種で共通に用いられている「シグナル伝達モジュール」であることも分かってきた。また、MAPキナーゼのスーパーファミリー(JNK,
p38など)の中には、ストレスに応答してアポトーシス(細胞の自殺)に関わるものがあることも示してきた。しかしながら、個々の現象を引き起こすときのMAPキナーゼのターゲットについては未だ必ずしも明らかではない。我々は特に細胞の生死と細胞癌化におけるシグナル伝達に注目して解析を行っている。
2. 細胞の生死制御とがん化
細胞の生死の制御がうまくいかなければ、必要な細胞が死んだり、死ぬべき細胞(例えばDNA損傷を受けた細胞、ウイルスに感染した細胞やガン細胞)が死ななくなって、個体の生命を脅かす。細胞の生死は、「生存シグナル伝達」と「死シグナル伝達」のバランスによって巧妙に制御されているが、我々はこのメカニズムの解明に取り組んでいる。
線虫から哺乳類まで進化的に保存されているアポトーシスのプログラムは、カスペースと呼ばれるプロテアーゼを中心としており、タンパク質分解を介して「不可逆的に」細胞死を誘導する。哺乳類では、周囲の環境や受けたダメージの程度を総合的に判断し、細胞が死ぬか否かを決めるための「可逆的プロセス」が存在し、不可逆的なカスペース経路を制御すると考えられる。我々は、細胞の生死決定に関わる、リン酸化を代表とした「可逆的プロセス」に注目し、現在(1)
Aktによる生存促進メカニズム及び(2) JNK依存的な細胞死誘導メカニズムを中心に検討している。
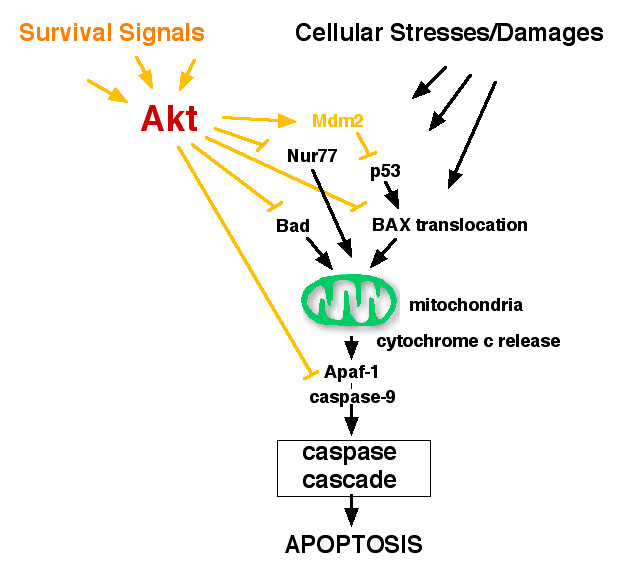
Aktは原癌遺伝子として同定され、また多くの癌組織でAktの活性化が見られており、癌化との深い関連が示唆されている。一般的に癌化促進機構として、1. 増殖促進、2. 生存促進、3.浸潤性の上昇、4. 血管新生、5. 不死化、などが挙げられるが、Aktの非常に強い生存促進活性は癌化に重要な貢献をしていると考えられている。我々は、Aktの生存促進における作用点として複数のターゲットを明らかにしつつある(図1)。一方、Aktの活性化は癌の悪性度・浸潤性と高い相関があることが指摘されており、この現象にはAktの生存促進以外の機能も関わっている事が予想された。実際、我々の研究室ではAktが哺乳類細胞の運動性を制御している事を明らかにした(図)。細胞運動は癌の浸潤にとどまらず、多くの生物学的現象に関わる細胞の基本的な性質であり、Aktの作用メカニズムは非常に興味深い。最近我々の実験によりAktが細胞極性の形成を介して運動性を制御している事が示唆されてきたので、現在その詳細を検討中である。
JNKは様々なストレス刺激で共通に活性化するセリン/スレオニンキナーゼである。我々を含めた幾つかのグループは、JNK経路がストレスによるカスペース経路の活性化に重要な役割を果たしていることを示してきた。さらに我々は、JNK経路の活性化が、カスペース非依存的細胞死を誘導しうることを示した。そこで現在、JNKの(i)カスペース活性化におけるターゲット、及び(ii)カスペース非依存的細胞死におけるターゲット、を検討している。近年、様々な発生過程や病理的細胞死の過程にカスペース非依存的な細胞死が関与することがわかってきた。そこで、JNK経路がこれらの過程に関与するかどうかを含め、JNK依存的細胞死の意義について検討している。
→JNKによる細胞死誘導機構の解析
3.大脳発生における神経系前駆細胞(神経幹細胞)の運命制御
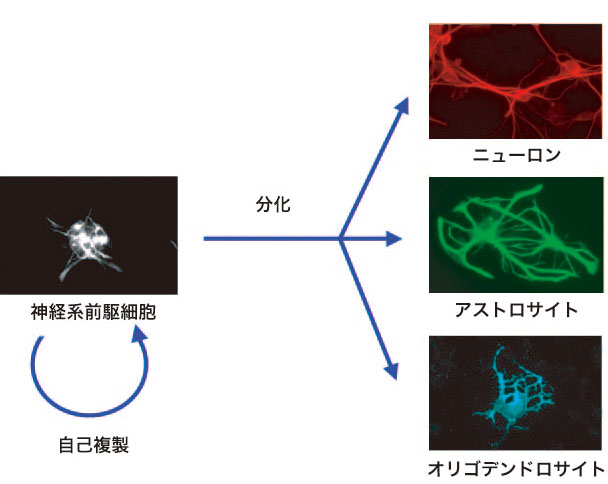
神経系前駆細胞とは、脳を構成する主要な細胞(種々のニューロンやグリア細胞)に分化する能力(多分化能)と増殖能を持った、未分化な細胞のことを指す。神経変成疾患で失われたニューロンを、この神経系前駆細胞(神経幹細胞)を用いて補うという再生医療の試みが始まっている。この時主なストラテジーとしては、(i)内在性の神経系前駆細胞を人工的に活性化して必要なニューロンに分化させる、あるいは(ii)
in vitroで神経系前駆細胞を培養し増殖・分化させてから移植する、という方法が考えられる。しかしながら、神経系前駆細胞の自己複製(分裂して同じ性質を持つ細胞を作ること)するメカニズムやそれぞれの分化形質への転換メカニズムは未だ多くが不明であり、必要な細胞を人工的に得ることは非常に限定的にしか行われていない。例えばin
vitroで神経系前駆細胞を培養し増殖させても、分裂回数を重ねるに伴って自己複製能を失い、特定の分化形質にコミットしてしまうことで、必要なニューロンが得られないというのが現状である。神経系前駆細胞の基本的な性質を知る事が今後の応用への鍵を握ると言って良い。
神経系前駆細胞の性質を知ることは、そもそもこの複雑な脳がいかにして構築されるかという生物学的に大きな疑問を解くのに不可欠である。どのようにして、何千種類ものニューロンとそれを支えるグリア細胞がそれぞれ必要な数、必要な場所に神経系前駆細胞から分化して出来てくるのか?神経系前駆細胞の中には、いわゆる「幹細胞」と呼べる細胞が含まれているのか?脳の修復・再生にどのくらい神経系前駆細胞は貢献しているのか?神経系前駆細胞の生死制御は脳の発生にどのように関わっているのか?我々の研究室ではマウス胎児大脳皮質由来の神経系前駆細胞を用いて、以上のような疑問に答えるべく運命制御機構を調べている。
脳発生において、神経系前駆細胞は、まず胎生早期にある程度自己複製(未分化なまま増殖)し、その後一部が胎生後期にニューロンへと分化して、一部が出生後にグリアへと分化することが知られている(図)。この自己複製から分化へと運命変換するタイミングの調節は、適正な数のニューロンとグリア細胞を産み出すのに非常に重要であるが、その制御メカニズムは殆ど明らかになっていない。我々は、胎生早期の大脳神経系前駆細胞において、NotchシグナルとFGFシグナルがSTAT3を活性化し、STAT3がこれらのシグナルによる神経系前駆細胞の自己複製能の促進に必須の役割を果たすことを明らかにした。しかし、同じSTAT3は胎生後期の大脳神経系前駆細胞においてはアストロサイト分化を促進することが知られている。また我々は、早期の大脳皮質神経系前駆細胞では自己複製を促進するWntシグナルが、後期では自己複製をむしろ阻害しニューロン分化を促進することを見出した。これらの結果から考えられる事は、分化誘導のタイミングを決める要因は「分化因子の発現誘導時期」ではなく、むしろ「分化因子に対する細胞側の応答性の時期依存的な変化」によるものであるということである(即ち、外からのシグナルではなく細胞側が分裂回数をカウントしていて、必要な時期に増殖から分化へのスイッチを行っていると言える)。そこで現在、神経系前駆細胞が時期だけの違いでなぜ異なるシグナル応答性を示すのかを検討している。この問題を解く事で、自己複製から分化に移行するタイミングを決めるメカニズムの理解に直結すると考えている。上記のように神経系前駆細胞をin
vitroで増殖させると多分化能を失ってしまう事が再生医療の障害になっているので、神経系前駆細胞の時期依存的な性質の理解は将来の再生医療の基盤にもなるであろう。