研究内容
1.脳発生における神経幹細胞の運命制御
2.エピゲノム/クロマチンレベルにおける神経幹細胞およびニューロンの運命制御
3.感染防御のシグナル伝達機構、脳における免疫系と神経系の機能連関 (岡崎:北大に2021.3異動)
1.脳発生における神経幹細胞の運命制御
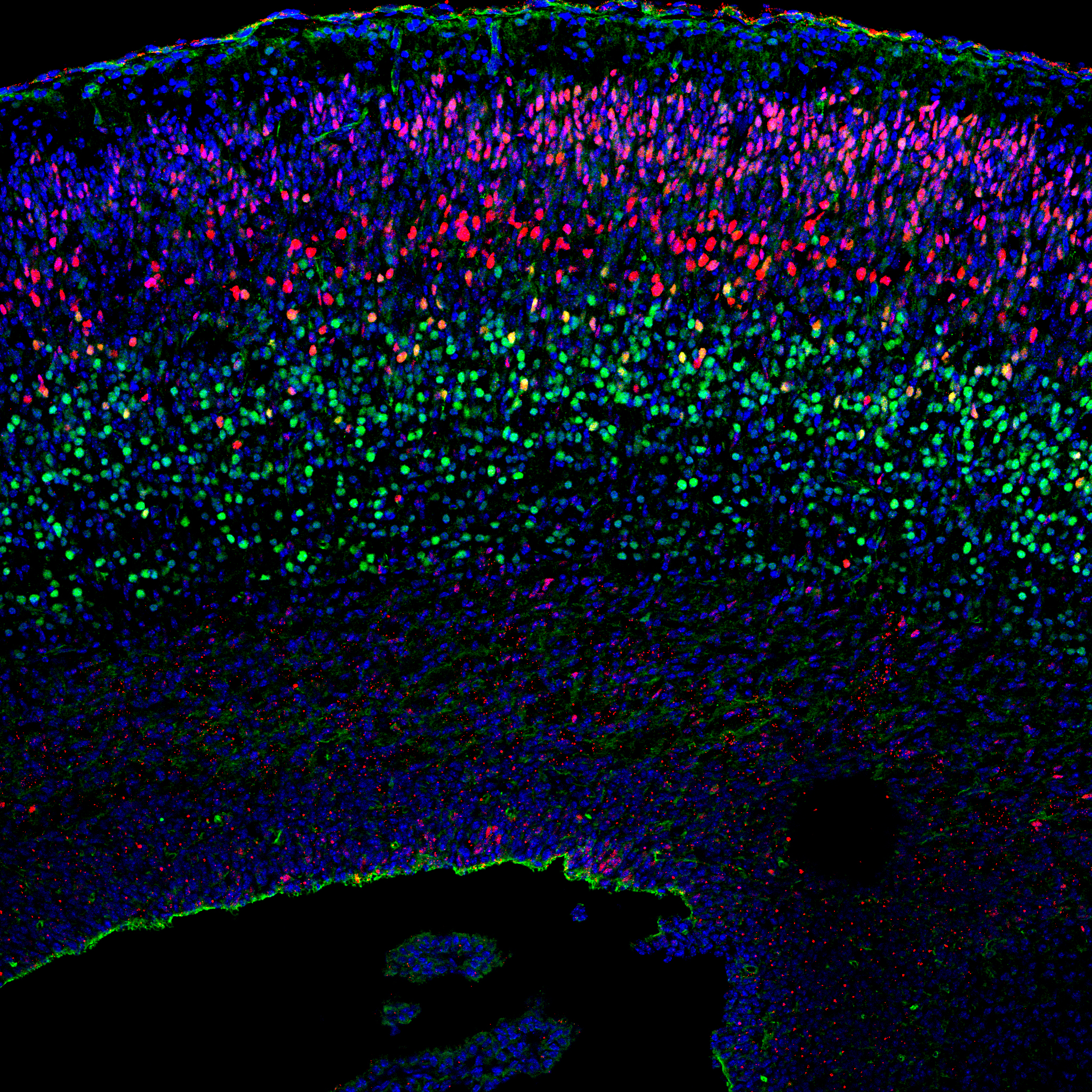 |
| 胎生期大脳新皮質 (赤,Brn2; 緑,Tbr1; 青,Hoechst) |
我々生命体が発生する際に、受精卵は分裂して直接個々の機能細胞を作りだす訳ではなく、まず各々の組織の幹細胞を産み出し、 その組織幹細胞が主軸となって様々な種類の細胞を作りだし機能的集団を作りだす。
組織幹細胞は、発生の間、未分化なまま増殖しながら、かつ一方で種々の分化細胞を産み出しその組織を構築する、という非常に興味深い細胞である。 では、どうやって幹細胞は適切に増殖と分化を制御し秩序だった組織を形成できるのだろうか?
特に神経系という組織においては、神経回路の素子である様々な種類のニューロンやグリア細胞を「正しい場所に」「正しい数」配置することが 機能的なネットワークを作る前提として必須である。したがって、神経幹細胞の運命がどのように制御されるかが、 この複雑で精巧な脳という組織を正しく作り上げるための鍵を握っていると言える。 我々は、哺乳類神経系をモデルに 「幹細胞とは何か(分子的にどのようにその機能が規定されているのか)」に迫り、 また幹細胞を通じて脳という魅力的な組織の構築原理に迫りたいと考えている。
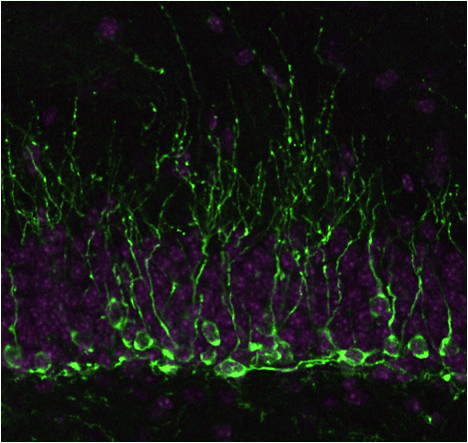 |
| 成体海馬新生ニューロン (緑,Dcx; 紫,Hoechst) |
神経幹細胞は、発生期だけでなく成体の脳にも存在し、一生の間ニューロンを作り続けていることが明らかになってきた。 この成体における新生ニューロンは、ある種の学習や記憶、また本能的・生得的な行動において必須の役割を果たしていることが示されて来ている。 更に脳の損傷時には神経幹細胞が活性化して、 損傷修復に寄与する可能性も示唆されている。そして新生ニューロンの数の減少は、 学習能力の低下や鬱などの精神疾患との相関が示されている。そこで我々は、成体における神経幹細胞が胎生期にどのように作られ、 いかにして長期間維持され、 必要に応じて正しい数と種類の新しいニューロン・グリア細胞を作っているのか、を明らかにすることを目指している。
「胎生期に、脳を作る神経幹細胞」と、「成体期に、長期維持されて恒常性を司り周囲の環境変化への適応を司る神経幹細胞」とでは、 機能も制御も大きく異なる。これら両方の運命制御機構の解析を通じて、 正しい脳の働きの理解につなげたいと考えている。
近年、種々の精神疾患が胎生期ならびに生後発達期における脳発生障害に由来することが明らかになってきている。 したがって、以上の神経幹細胞に関する研究(および次の項で述べるニューロン成熟や神経・免疫連関に関する研究)は、 我々の脳に対する理解につながるだけでなく、 神経幹細胞を用いた再生医療や、精神疾患・神経疾患治療への重要な基盤となるであろう。
- i.発生期のマウス脳における神経幹細胞の運命制御について
- 発生期における神経幹細胞の分化ポテンシャル制御 (背景)
- (1)神経幹細胞の増殖期からニューロン分化期への転換
- (2)神経幹細胞のニューロン分化期内、およびニューロン分化期からグリア分化期への転換
- (3)ポリコーム群タンパク質、HMGAタンパク質による幹細胞運命転換
- (4)分化したニューロンが移動を開始するメカニズム
- (5)アストロサイトの多様性と分化制御
- (6)大脳領野形成機構
- ii. 成体期のマウス脳における神経幹細胞の運命制御について
- 成体神経幹細胞のニューロン産生効率を司る分子p57
- 成体神経幹細胞が長期にわたって維持されるメカニズムについて(分裂頻度、ニッチ、非対称分裂)
- iii.成体神経幹細胞の起源とは?
↑ページ上部へ
2.エピゲノム/クロマチンレベルにおける神経幹細胞およびニューロンの運命制御
脳を構成するニューロンは複雑で緻密な神経回路網を形成しており、これが高次機能を果たす基盤となっている。 この神経回路の形成には、その素子である個々のニューロンが正しく分化・成熟することが重要である。 また成熟中・成熟後の神経回路は可塑性を持ち、特定の刺激に応じた回路の増強と減弱を経て特定の機能を持つ回路へとアップデートする。
我々が着目している大脳新皮質の発生過程において、神経幹細胞(神経系前駆細胞あるいは放射状グリアとも呼ぶ)から分化した ニューロンは皮質板へと移動し、ニューロンの種類に応じた配置をし、軸索や樹状突起を伸展させそれぞれに特徴的な形態を獲得する。 さらに、膜電位の確立や他のニューロンとのシナプス結合を通じて機能的な神経回路網を形成する。 神経回路網の確立にはアストロサイトや オリゴデンドロサイトといったマクログリアと脳内常在免疫細胞であるミクログリアも関わっている。
神経幹細胞がニューロンに分化し、神経回路を確立する際には、非常に多くの遺伝子(哺乳類の約2万ある遺伝子のうち1割以上)が発現誘導し動員される。 遺伝子発現のみならず、スプライシングパターンも大きく変化する。この大規模な転写パターンの変化を協調的に惹起するメカニズムは何だろうか? 我々はクロマチンレベルの大規模な変化とそれを裏付けるメカニズムを同定しつつあり、ニューロンの特殊性が明らかになってきた。 また、ニューロンとグリアの相互作用による神経回路の確立機構にも迫りつつある。さらに最近、神経活動による クロマチンレベルの新しい変化も解明してきており、これらを通じて神経回路可塑性の核基盤の理解を深めたいと考えている。
3.感染防御のシグナル伝達機構、脳における免疫系と神経系の機能連関
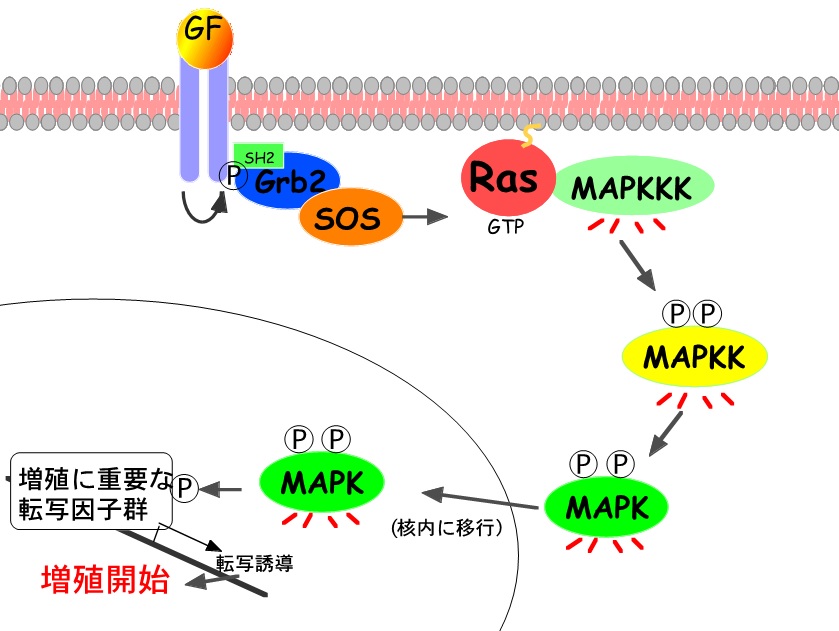 |
| MAP Kinase経路(拡大) |
後藤らは脊椎動物のMAP kinase経路(MEK-ERK経路)の同定に貢献し、 細胞内増殖シグナル伝達の重要な構成因子を世界に先駆けて明らかにした(Gotoh et al. Nature 1991など)。 以来、MAP kinase経路は細胞内シグナル伝達経路のプロトタイプとして世界中で集中的に研究されてきた。当研究室では、MAP kinase経路に留まらず、 個々の細胞が細胞外から受け取ったシグナルを(細胞内の情報と合わせて)どのように解釈し細胞運命に反映させるのかについて研究を進めている。
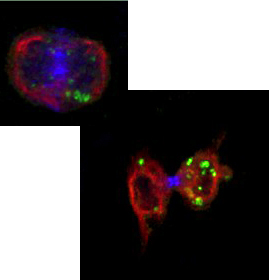
ウイルス感染に対する防御機構について(背景)
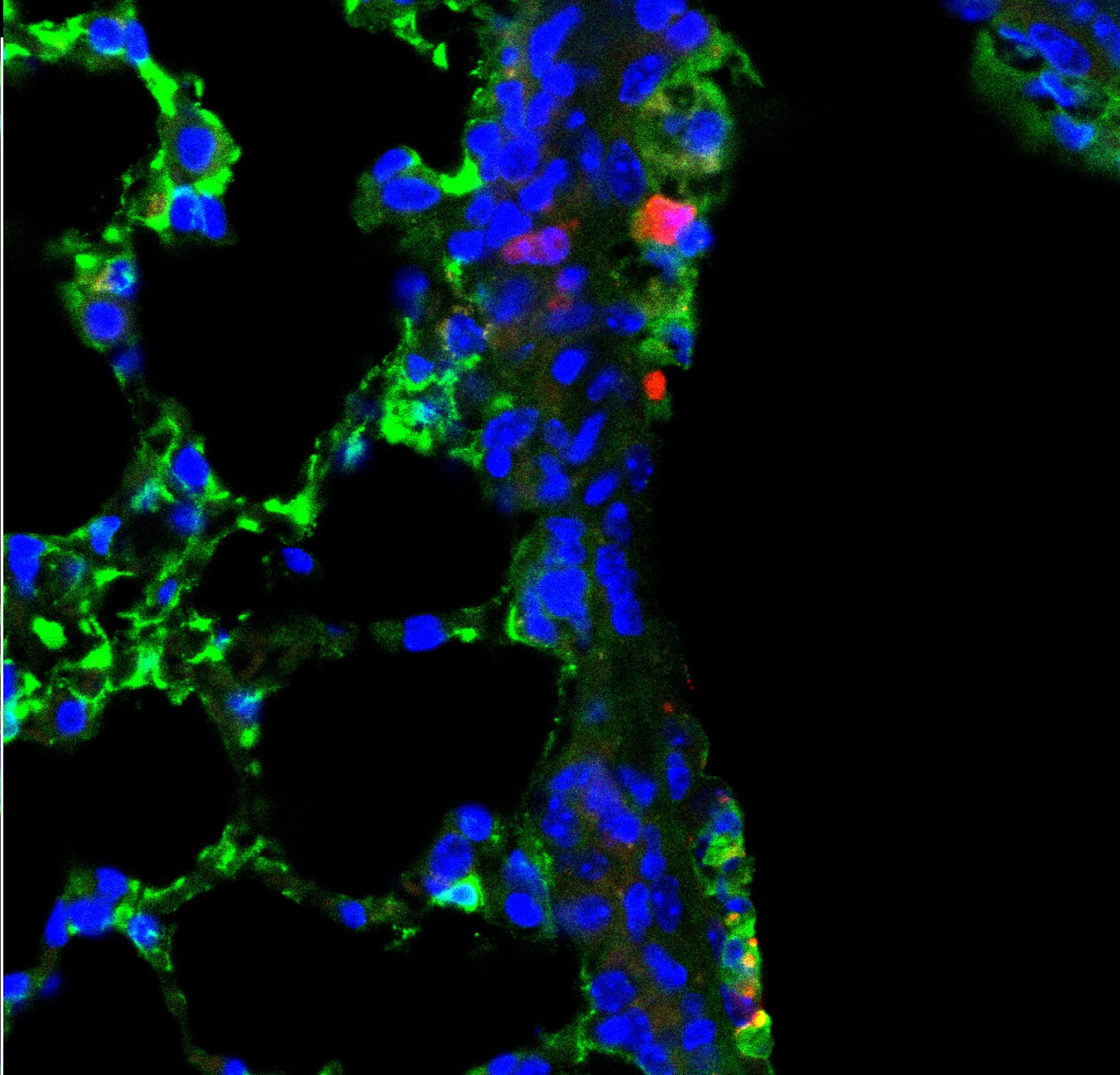 |
| インフルエンザウイルス感染 マウス肺 (赤,活性型Casp-3; 緑,感染細胞; 青,Hoechst) |
哺乳類はウイルス感染すると、獲得免疫系を動かす前に、初期応答として自然免疫系を用いてウイルスに対抗し、 感染の拡大を抑止する。この自然免疫系においては、細胞内でウイルス由来のRNAを感知してシグナルを伝えるRIG-I-like receptorファミリーと、 そのアダプター分子IPS-1/MAVSが重要な役割を果たす。IPS-1はミトコンドリア膜上に主に局在し、これまでIPS-1の下流では インターフェロン発現誘導やアポトーシス誘導といった宿主応答が惹起されることが知られていた。 しかし、どのような感染の状況によって、またどのようなメカニズムによってこれらの宿主応答が使い分けられているのかについては不明であった。 当研究室ではIPS-1の新規の修飾や結合分子を同定し、この問題に迫っている。またウイルス感染に応答したアポトーシス誘導メカニズムも検討し、 新しい感染防御メカニズムを明らかにしつつある。